
Le prime pile utilizzabili nacquero nei laboratori della Royal Society a Londra: W. Wollaston (1766-1828) perfeziono’ la pila a tazze di Volta, dotandola di elettrodi estraibili ed utilizzando un elettrolito con acido solforico e nitrito diluiti.
Nel 1839 Sir William Grove sperimento’ la prima pila a gas idrogeno ed ossigeno, constatandone la reversibilità: con cio’ stabilì i principi della pila a combustibile.
A Parigi gli studi di molti elettrochimici portarono all’invenzione dell’accumulatore al piombo (G. Planté) e della pila allo zinco-biossido di manganese (G. Leclanché). La pila Grenet, che utilizzava la coppia zinco-carbone in una soluzione in acido solforico di bicromato potassico, nel 1879 fu usata da Edison per l’illuminazione domestica.
Fino a tempi recenti il mercato delle “batterie” è stato dominato da sistemi basati su concetti risalenti al secolo scorso. Anche i sistemi ricaricabili, cioe’ gli accumulatori elettrochimici di uso più comune, quali il nichel-cadmio e il piombo-acido, operano sulla base di processi elettrochimici proposti nel tardo 1800 da W. Jungner e G. Planté.
Un notevole progresso è stato ottenuto piu’ recentemente con l’utilizzo di materiali elettrodici al litio per produrre accumulatori in grado di offrire densità di energia piu’ di tre volte superiori a quelli dell’accumulatore al piombo.
1) Accumulatore al piombo di G. Planté.
2) Pila a combustibile, Impianto AEM, Milano – Bicocca.
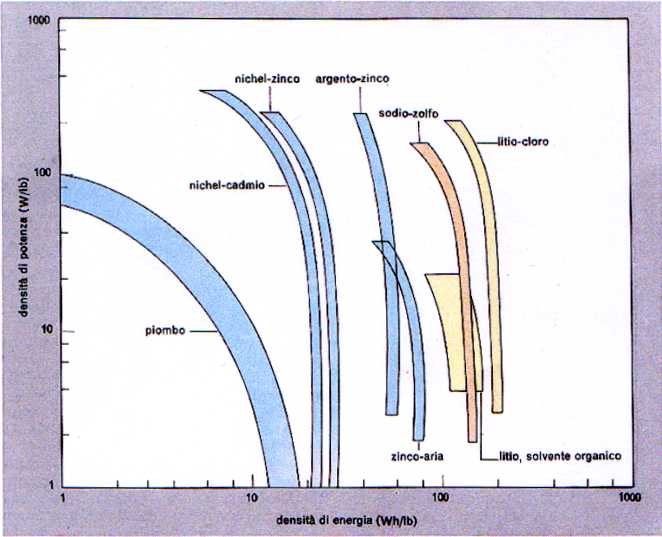
3) Caratteristiche operative di alcune batterie. Notare che le massime densita’ di energia si raggiungono con batterie al litio (da Enciclopedia della Scienza e della Tecnica).


Batteria (o pila) primaria: Le reazioni chimiche che avvengono durante l’erogazione di corrente (processo di scarica) non sono praticamente invertibili: si ottiene così una sola scarica.
Batteria (o pila) secondaria: Le reazioni chimiche che accompagnano il processo di scarica sono invertibili e l’elemento puo’ essere ricaricato per passaggio di corrente in senso inverso a quello di scarica.
Pila elettrica: Sistema elettrochimico che realizza la conversione diretta di energia chimica in energia elettrica.
Pila a combustibile: La differenza rispetto alle pile e alle batterie consiste nel diverso immagazzinamento delle sostanze reattive; il combustibile (idrogeno, idrocarburi) e l’ossidante (ossigeno, aria, cloro) sono conservati esternamente alla cella in opportuni serbatoi.